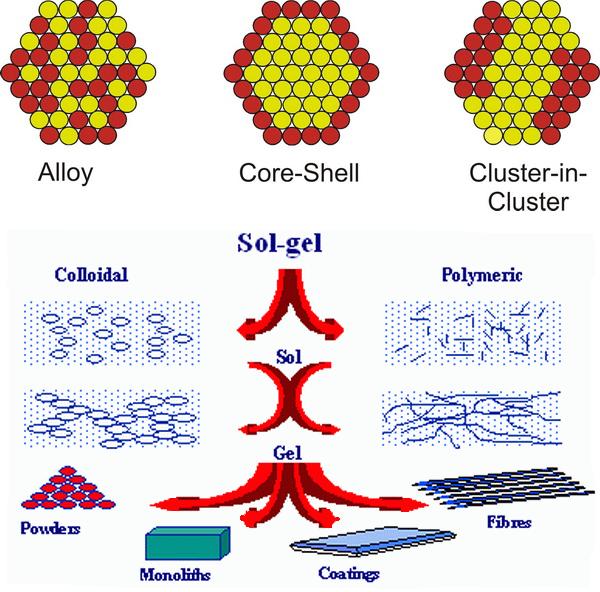
سل-ژل Sol-gel
فرایند سل-ژل (به انگلیسی: Sol-gel) که همچنین با نام رسوبدهی محلول شیمیایی (به انگلیسی: Chemical Solution Deposition) از آن یاد میشود، یک روش شیمی تر است که در مهندسی و علم مواد و مهندسی سرامیک به طور گسترده استفاده میشود. این روش معمولاً برای تولید مواد (به عنوان مثال اکسید فلزات) با شروع از یک محلول کلوئیدی(سل) که به عنوان پیشماده برای یک شبکه بههمپیوسته (ژل) از ذرات گسسته یا پلیمرهای شبکهای است، بکار میرود. پیشمادههای معمول شامل آلکوکسید و نمک فلزات (از قبیل کلریدها، نیتریدها و استات ها)هستند که تحت واکنشهای مختلف هیدرولیز و بسپارش مرحلهای قرار میگیرند.
انواع روش های سل- ژل بر اساس نوع پیش ماده مورده استفاده
تقسیم بندی بر اساس نوع نمک
۱-پیش ماده های آلکوکسیدی
۲-پیش ماده های نمک فلزی
تقسیم بندی بر اساس نوع محیط پیرامون
۱-پیش ماده های پلیمری
۲-پیش ماده های آبی
کلوئید
اصطلاح کلوئید از ترکیب دو کلمه یونانی Kolla (به معنی چسب)و eidos (به معنای شبیه)بدست آمده است که اولین بار توسط دانشمند انگلیسی بنام توماس گراهام بکار برده شد.
سل
عموماً سل عبارت است از سوسپانسیون پایدار از ذرات جامد کلوئیدی و یا پلیمری که در یک مایع قرار دارند . این ذرات می توانند آمورف و یا کریستالی باشند . ذرات جامد کلوئیدی که ابعادی نانومتری دارند از طریق دو واکنش تشکیل می شوند به زبانی سادهتر سل مخلوطی است از جامدهایی با اندازههای متفاوت و بین 1 تا 100 نانومتر در آب که ته نشین نمیشوند و عبارتند از:
۱) هیدرولیز: در اثر حل شدن نمک در آب، کاتیون فلزی با آب کمپلکس تشکیل می دهد . در این حالت انتقال جفت الکترون از مولکول آب به اربیتال های خالی کاتیون فلز واسطه وجود دارد . بار جزئی هیدروژن افزایش می یابد و مولکول آب خاصیت اسیدی پیدا می کند . بر اساس مقدار اسیدی بودن آب ، انواع واکنش های هیدرولیز را می توان د اشت. به طور کلی با افزایش دانسیته بار فلز، افزایش تعداد پل های یون های فلزی توسط لیگاند های اکسو و هیدروکسو و افزایش تعداد هیدروژن موجود در لیگاندها، هیدرولیز آسان تر می شود .
۲) کندانسیون: این واکنش توسط دو مکانیزم مختلف هسته دوستی انجام می شود و بستگی به عدد همسایگی فلز دارد . وقتی عدد همسایگی مورد نظر مهیا باشد، کندانسیون توسط یک واکنش جانشینی هسته دوستی انجام می شود و وقتی عدد همسایگی مورد نظر فلز مهیا نباشد، افزودنی هسته دوستی وجود دارد. واکنش کندانسیون که در واقع نوعی پلیمراسیون محسوب می شود خود به دو دسته تقسیم می شود:
۱- الیشن: یک فرایند کندانسیون است به طوری که پل های هیدروکسیدی بین دو فلز به وجود می آید.
۲- اکسیلیشن: واکنش کندانسیونی است که در آن پل های اکسیژنی بین دو فلز به وجود می آید .
مراحل تشکیل سل
مراحل تشکیل سل به طور کلی به دو دسته تقسیم بندی می شوند:
۱- تشکیل محلولی حقیقی از پیش ماده ها(پیش ماده های آلکوکسیدی یا پیش ماده های نمک فلزی) مورد نظر در حلال که می تواند آب، الکل یا اسید باشد.
۲- تشکیل محلول کلوئیدی(سل) از طریق تبدیل اتم های فلزی به کامپلکس های فلزی توسط واکنش های هیدرولیز و کندانسیون، که در واقع واکنش های به وجود آورنده ذرات کلوئیدی می باشند، با انجام این واکنش ها ذرات بزرگ شده و به ابعاد ذرات کلوئیدی یعنی ۱nm تا حدود ۱۰۰nm می رسند. در این مرحله نانوذرات که معمولاً آمورف می باشند تشکیل شده است.
۳- پایدار کردن ذرات کلوئیدی و جلوگیری از ته نشین شدن آن ها توسط یک عامل پایدار کننده. این عامل می تواند توسط کنترل عوامل محیطی از قبیل کنترل pH، دمای سل، میزان همزدن سل کنترل شود یا از طریق افزودن مواد شیمیایی کنترل گردد.
تفاوت سل با محلول
کلوئیدها از یک نظر شبیه محلولها هستند و از جهاتی دیگر بکلی با آنها متفاوتند. هر سیستم کلوئیدی حداقل دارای دو بخش است:
۱ – فاز پراکنده
۲ – محیط پراکندگی
اما محلولهای حقیقی فقط یک فاز دارند و ماده حل شده و حلال باهم یک فاز را تشکیل میدهند. تفاوت بعدی اندازه ذرات در سل یعنی کلوئیدها و اندازه ذره در محلول یعنی اتم ها و یون ها است. در سل اندازه ذرات کلوئیدی معمولاً بین ۵۰ تا ۲۰۰۰ آنگستروم است. اما در محلول اندازه اتم ها و یون ها در حد آنگستروم است.
اندازههای کلوییدی
اگر جسمی را که نرم ساییده شده است در آب بریزیم، یکی از سه حالت زیر پیش میآید:
۱. ممکن است یک «محلول حقیقی» تشکیل شود که نتیجهی پراکنده شدنِ اتمها، مولکولها یا یونهای آن جسم در یک حلاّل است. اندازهی ذرات در این محلول از حدود ۱nm تجاوز نمیکند؛
۲. این امکان وجود دارد که ذراتِ بزرگتر از حدود ۱۰۰nm باقی بمانند. این ذرات میکروسکوپی، بهتدریج تهنشین میشوند. از آنجا که این ذرات به طور موقت معلقاند و بر اثر ماندن تهنشین میشوند، به مخلوط حاصل، «مخلوط معلق» یا «سوسپانسیون» میگویند؛
۳. ذراتی که اندازهی آنها از ۱nm تا حدود ۱۰۰nm تغییر میکند، معمولاً به صورت پراکنده در همهجای محیط باقی میمانند. این نوع مخلوط «کلویید» نامیده میشود. به عبارت دیگر، در یک مخلوط کلوییدی با «نانوذرات» سروکار داریم.
کلوییدها در میانهی سوسپانسیونها و محلولها قرار میگیرند، ولی ناهمگن به شمار میروند. محیطهای پیوسته همچون آب یا الکل و جسم پراکنده، هرکدام وضعیت جداگانهای به وجود میآورند.
پایدار سازی سل
منظور از پایدار سازی سل این است که ذرات کلوئیدی ته نشین نشوند و همچنان به صورت سوسپانسیون باقی بمانند تا بتوان همچنان به آن طبق تعریف سل گفته شود.پایداری و یا انعقاد سل در فرایند سل - ژل بسیار مهم می باشد و ساختار و شبکه ژل به دست آمده با اندازه و شکل ذرات تجمع یافته اولیه مرتبط می باشد .
انواع سل
سل کلوئیدی
منظور از سل کلوئیدی سلی است که در آن تشکیل ژل فقط از طریق چسبیدن(آگلومراسیون) ذرات کلوئیدی بوجود می آید.
سل های کلوئیدی مونودیسپرس
در این نوع سل ها، تمام ذرات دارای شکل و اندازه یکسان می باشند و تشکیل این نوع سل به دلیل میل شدید به آگلومره شدن بسیار دشوار است.
سل های کلوئیدی پلی دیسپرس
اکثر سیستم های کلو ئیدی به این صورت می باشند و اندازه ذرات در آنها یکسان نیست و برای بیان اندازه ذرات از متوسط مقادیر استفاده می شود.
سل های ماکرومولکولی یا پلیمری
ادامه نوشته
انواع روش های سل- ژل بر اساس نوع پیش ماده مورده استفاده
تقسیم بندی بر اساس نوع نمک
۱-پیش ماده های آلکوکسیدی
۲-پیش ماده های نمک فلزی
تقسیم بندی بر اساس نوع محیط پیرامون
۱-پیش ماده های پلیمری
۲-پیش ماده های آبی
کلوئید
اصطلاح کلوئید از ترکیب دو کلمه یونانی Kolla (به معنی چسب)و eidos (به معنای شبیه)بدست آمده است که اولین بار توسط دانشمند انگلیسی بنام توماس گراهام بکار برده شد.
سل
عموماً سل عبارت است از سوسپانسیون پایدار از ذرات جامد کلوئیدی و یا پلیمری که در یک مایع قرار دارند . این ذرات می توانند آمورف و یا کریستالی باشند . ذرات جامد کلوئیدی که ابعادی نانومتری دارند از طریق دو واکنش تشکیل می شوند به زبانی سادهتر سل مخلوطی است از جامدهایی با اندازههای متفاوت و بین 1 تا 100 نانومتر در آب که ته نشین نمیشوند و عبارتند از:
۱) هیدرولیز: در اثر حل شدن نمک در آب، کاتیون فلزی با آب کمپلکس تشکیل می دهد . در این حالت انتقال جفت الکترون از مولکول آب به اربیتال های خالی کاتیون فلز واسطه وجود دارد . بار جزئی هیدروژن افزایش می یابد و مولکول آب خاصیت اسیدی پیدا می کند . بر اساس مقدار اسیدی بودن آب ، انواع واکنش های هیدرولیز را می توان د اشت. به طور کلی با افزایش دانسیته بار فلز، افزایش تعداد پل های یون های فلزی توسط لیگاند های اکسو و هیدروکسو و افزایش تعداد هیدروژن موجود در لیگاندها، هیدرولیز آسان تر می شود .
۲) کندانسیون: این واکنش توسط دو مکانیزم مختلف هسته دوستی انجام می شود و بستگی به عدد همسایگی فلز دارد . وقتی عدد همسایگی مورد نظر مهیا باشد، کندانسیون توسط یک واکنش جانشینی هسته دوستی انجام می شود و وقتی عدد همسایگی مورد نظر فلز مهیا نباشد، افزودنی هسته دوستی وجود دارد. واکنش کندانسیون که در واقع نوعی پلیمراسیون محسوب می شود خود به دو دسته تقسیم می شود:
۱- الیشن: یک فرایند کندانسیون است به طوری که پل های هیدروکسیدی بین دو فلز به وجود می آید.
۲- اکسیلیشن: واکنش کندانسیونی است که در آن پل های اکسیژنی بین دو فلز به وجود می آید .
مراحل تشکیل سل
مراحل تشکیل سل به طور کلی به دو دسته تقسیم بندی می شوند:
۱- تشکیل محلولی حقیقی از پیش ماده ها(پیش ماده های آلکوکسیدی یا پیش ماده های نمک فلزی) مورد نظر در حلال که می تواند آب، الکل یا اسید باشد.
۲- تشکیل محلول کلوئیدی(سل) از طریق تبدیل اتم های فلزی به کامپلکس های فلزی توسط واکنش های هیدرولیز و کندانسیون، که در واقع واکنش های به وجود آورنده ذرات کلوئیدی می باشند، با انجام این واکنش ها ذرات بزرگ شده و به ابعاد ذرات کلوئیدی یعنی ۱nm تا حدود ۱۰۰nm می رسند. در این مرحله نانوذرات که معمولاً آمورف می باشند تشکیل شده است.
۳- پایدار کردن ذرات کلوئیدی و جلوگیری از ته نشین شدن آن ها توسط یک عامل پایدار کننده. این عامل می تواند توسط کنترل عوامل محیطی از قبیل کنترل pH، دمای سل، میزان همزدن سل کنترل شود یا از طریق افزودن مواد شیمیایی کنترل گردد.
تفاوت سل با محلول
کلوئیدها از یک نظر شبیه محلولها هستند و از جهاتی دیگر بکلی با آنها متفاوتند. هر سیستم کلوئیدی حداقل دارای دو بخش است:
۱ – فاز پراکنده
۲ – محیط پراکندگی
اما محلولهای حقیقی فقط یک فاز دارند و ماده حل شده و حلال باهم یک فاز را تشکیل میدهند. تفاوت بعدی اندازه ذرات در سل یعنی کلوئیدها و اندازه ذره در محلول یعنی اتم ها و یون ها است. در سل اندازه ذرات کلوئیدی معمولاً بین ۵۰ تا ۲۰۰۰ آنگستروم است. اما در محلول اندازه اتم ها و یون ها در حد آنگستروم است.
اندازههای کلوییدی
اگر جسمی را که نرم ساییده شده است در آب بریزیم، یکی از سه حالت زیر پیش میآید:
۱. ممکن است یک «محلول حقیقی» تشکیل شود که نتیجهی پراکنده شدنِ اتمها، مولکولها یا یونهای آن جسم در یک حلاّل است. اندازهی ذرات در این محلول از حدود ۱nm تجاوز نمیکند؛
۲. این امکان وجود دارد که ذراتِ بزرگتر از حدود ۱۰۰nm باقی بمانند. این ذرات میکروسکوپی، بهتدریج تهنشین میشوند. از آنجا که این ذرات به طور موقت معلقاند و بر اثر ماندن تهنشین میشوند، به مخلوط حاصل، «مخلوط معلق» یا «سوسپانسیون» میگویند؛
۳. ذراتی که اندازهی آنها از ۱nm تا حدود ۱۰۰nm تغییر میکند، معمولاً به صورت پراکنده در همهجای محیط باقی میمانند. این نوع مخلوط «کلویید» نامیده میشود. به عبارت دیگر، در یک مخلوط کلوییدی با «نانوذرات» سروکار داریم.
کلوییدها در میانهی سوسپانسیونها و محلولها قرار میگیرند، ولی ناهمگن به شمار میروند. محیطهای پیوسته همچون آب یا الکل و جسم پراکنده، هرکدام وضعیت جداگانهای به وجود میآورند.
پایدار سازی سل
منظور از پایدار سازی سل این است که ذرات کلوئیدی ته نشین نشوند و همچنان به صورت سوسپانسیون باقی بمانند تا بتوان همچنان به آن طبق تعریف سل گفته شود.پایداری و یا انعقاد سل در فرایند سل - ژل بسیار مهم می باشد و ساختار و شبکه ژل به دست آمده با اندازه و شکل ذرات تجمع یافته اولیه مرتبط می باشد .
انواع سل
سل کلوئیدی
منظور از سل کلوئیدی سلی است که در آن تشکیل ژل فقط از طریق چسبیدن(آگلومراسیون) ذرات کلوئیدی بوجود می آید.
سل های کلوئیدی مونودیسپرس
در این نوع سل ها، تمام ذرات دارای شکل و اندازه یکسان می باشند و تشکیل این نوع سل به دلیل میل شدید به آگلومره شدن بسیار دشوار است.
سل های کلوئیدی پلی دیسپرس
اکثر سیستم های کلو ئیدی به این صورت می باشند و اندازه ذرات در آنها یکسان نیست و برای بیان اندازه ذرات از متوسط مقادیر استفاده می شود.
سل های ماکرومولکولی یا پلیمری
+ نوشته شده در یازدهم آبان ۱۳۹۲ ساعت توسط مجید غفوری
 به لطف خدا،metallurgydata کاملترین و پر بازدیدترین(آمار حقیقی و قابل باز دید)مرجع اطلاعات مواد و متالورژی با بیش از 1300 عنوان ،شامل هزاران متن،کتاب،تصوير،فيلم تخصصی
به لطف خدا،metallurgydata کاملترین و پر بازدیدترین(آمار حقیقی و قابل باز دید)مرجع اطلاعات مواد و متالورژی با بیش از 1300 عنوان ،شامل هزاران متن،کتاب،تصوير،فيلم تخصصی